怎么写路易士电子结构
答案未评审
修改时间
浏览量
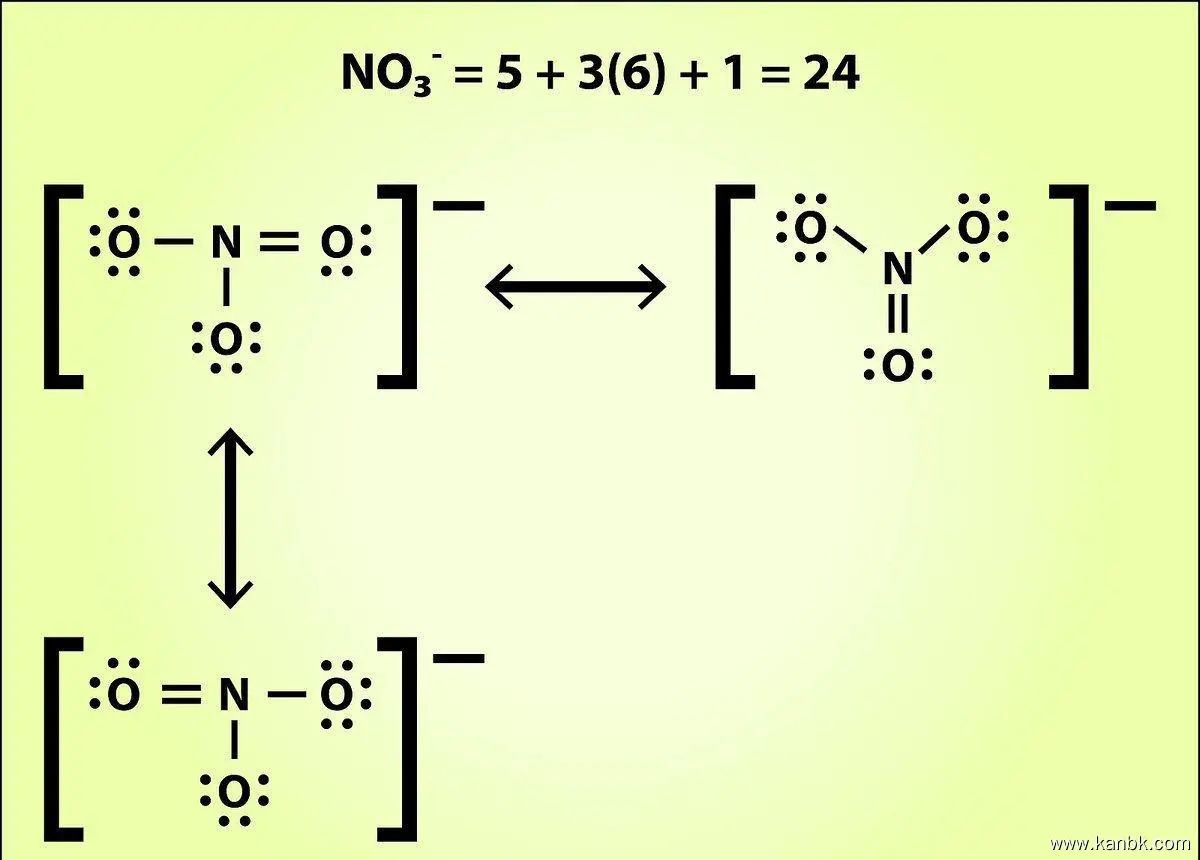
路易士电子结构指的是原子中电子在能级上的分布情况,它描述了原子中每个电子所处的能量状态和空间分布。写路易士电子结构需要遵循以下步骤:
确定原子的核电荷数 路易士电子结构的第一步是确定原子的核电荷数,即原子核所带的正电荷数目。核电荷数通常等于原子的电子数,因为原子在中性状态下有相等的负电子和正质子数。
确定能级数量 原子的能级数量取决于其核电荷数和电子数。每个能级可以容纳一定数量的电子,由于能级的容量是固定的,因此必须根据原子的电子数选择适当数量的能级。
填充能级 填充能级的顺序遵循一定的规则。根据泡利不相容原理和阿伦尼乌斯原理,填充顺序应按照从低能级到高能级、每个能级最多填充两个电子以及同一能级内的电子应具有不同的自旋方向。
写出路易士电子结构符号 路易士电子结构符号通常采用数字和字母来表示电子的能级和自旋方向。每个能级都用一个数字表示,同时将所有的电子按照填充顺序写在相应的能级下面,并使用上箭头(↑)和下箭头(↓)表示它们的自旋方向。
例如,碳原子的路易士电子结构符号为1s²2s²2p²,其中1s²表示第一能级有两个电子,2s²表示第二能级有两个电子,2p²表示第三能级的p轨道上有两个电子。
总之,写出路易士电子结构需要先确定原子的核电荷数和能级数量,然后按照填充规则填充能级,最后将电子的能级和自旋方向用符号表示出来。